Atombindungen im Raum
Eine Atombindung bildet sich also, indem sich zwei Orbitale, die mit je einem Elektron besetzt sind, überlappen.
Nun hat man festgestellt, dass Atombindungen bestimmte Richtungen im Raum haben. Nehmen wir zum Beispiel das
Wasser: Im Wassermolekül (Formel: H2O)
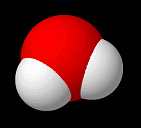 ist ein Sauerstoffatom (6 Außenelektronen, also 2 doppelt und 2 einfach besetzte Orbitale)
durch Atombindungen mit 2 Wasserstoffatomen (je ein Außenelektron) verbunden.
Wie man zeigen konnte (z. B. durch
Röntgenbeugung), sind Wassermoleküle gewinkelt.
ist ein Sauerstoffatom (6 Außenelektronen, also 2 doppelt und 2 einfach besetzte Orbitale)
durch Atombindungen mit 2 Wasserstoffatomen (je ein Außenelektron) verbunden.
Wie man zeigen konnte (z. B. durch
Röntgenbeugung), sind Wassermoleküle gewinkelt.
Um diese Tatsache zu erklären, nimmt man an, dass die Orbitale ihrerseits in bestimmter Weise
räumlich angeordnet sind, nämlich tetraedrisch, wie auf dem oben bereits (und hier nochmals) gezeigten Bild.
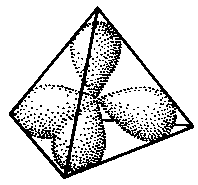 Die Überlappung erklärt dann die räumliche Struktur des Moleküls: Beim Sauerstoffatom
sind 2 Orbitale schon mit je 2 Elektronen besetzt, 2 Orbitale haben je ein Elektron. Diese beiden Orbitale
überlappen sich mit den einfach besetzten Orbitalen der beiden Wasserstoffatome, wodurch der Winkel
entsteht (Das Orbital für die erste Schale ist Kugelförmig).
Die Überlappung erklärt dann die räumliche Struktur des Moleküls: Beim Sauerstoffatom
sind 2 Orbitale schon mit je 2 Elektronen besetzt, 2 Orbitale haben je ein Elektron. Diese beiden Orbitale
überlappen sich mit den einfach besetzten Orbitalen der beiden Wasserstoffatome, wodurch der Winkel
entsteht (Das Orbital für die erste Schale ist Kugelförmig).
