|
|
|
|
Die Chloratome sind nun aber in Bewegung (Wärmebewegung). Sie fliegen mit hoher Geschwindigkeit (unter normalen Umständen einige 100 km/sec) geradeaus, solange, bis sie ein Hindernis treffen (im Durchschnitt nach 0.1 bis 1 Nanosekunden): ein anderes Chloratome oder z.B. die Wand des Behälters.
Bei einem Zusammenprall kommt es in den meisten Fällen dazu, dass das Atom zurückprallt, weil sich die negativ geladenen äußeren Bereiche der Atome gegenseitig abstoßen.
Jetzt bitte die Schaltfläche „2. >> 3.“ anklicken und beobachten, was passiert.
Wenn der Zusammenprall aber gerade richtig ist: nicht zu fest, nicht zu schwach, dann kann es passieren, dass sich 2 Orbitale, die mit je einem Elektron besetzt sind, überlappen. Dadurch entsteht ein zweifach (also maximal) besetztes Orbital, welches sich die beiden Chloratome miteinander teilen. Nun ist die Oktettregel für beide Chloratome erfüllt.
Da die Bindung von 2 Elektronen gebildet wird, spricht man auch von einer Elektronenpaarbindung. Synonyme sind: Atombindung, kovalente Bindung.
Die Atombindung, erklärt am Beispiel des Chlor-Moleküls
Chlor kommt bekanntlich in Molekülen mit jeweis zwei Atomen vor. Wie kann man das auf der Ebene der Atome erklären?
Die Animation zeigt zwei einzelne Atome Chlor.
Wir wissen alle, dass die Welt sich in den sehr kleinen Maßstäben, in denen wir uns hier bewegen, nicht so verhält wie wir es aus unserem Alltag gewohnt sind. Z.B. sind die Elementarteilchen keine Kugeln mit einer harten Oberfläche, wie etwa Holzkugeln. Auch haben sie natürlich keine Farbe. Trotzdem hilft es, wenn wir uns eine Vorstellung machen, wie hier in der Animation. Man spricht deshalb von „Modellen”.
Einiges in der Animation werden Sie wiedererkennen: es gibt einen Atomkern, hier blau dargestellt, um den herum sich die Elektronen (ockerfarben dargestellt) in mehreren Schalen bewegen. Zuinnerst kreisen jeweils 2 Elektronen um den Kern (erste Schale), dann etwas weiter vom Kern entfernt, 8 Elektronen (2. Schale).
Die äußerste Schale ist hier anders dargestellt, als Sie es gewohnt sind: die Elektronen sind nicht kreisförmig um den Atomkern verteilt, sondern halten sich in 4 Bereichen auf, die hier als Ellipsen gezeigt werden. Diese Darstellung ist ein Kompromiss, um die Verältnisse irgendwie in 2 Dimensionen (also flach) darzustellen. Aufgrund des Welle-Teilchen-Dualismus kann man die Elektronenverteilung nicht nur als kreisende Teilchen beschreiben, sondern auch als wolkenartige Gebilde. Diese „Wolken” (Fachausdruck: Orbitale) verteilen sich räumlich wegen der Abstoßung zwischen den Elektronen gleichmäßig um den Kern; jede Wolke ist der Aufenthaltsort für jeweils maximal 2 Elektronen (Elektronen lieben es aus Gründen, deren Erläuterung jetzt zu weit füren würde, paarweise aufzutreten). Die ersten 8 Elektronen der dritte Schale werden also auf 4 Orbitale verteilt – man nennt dies auch Elektronenpaarabstoßungsmodell. (Hier eine Anmerkung zu den 10 Elektronen, die eigentlich auch noch auf die 3. Schale passen).
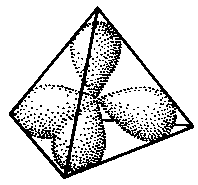
Man muss sich dies räumlich etwa so vorstellen, wie in dem Bild.
Da die Animation zweidimensional ist, wurden die 4 Wolken alle in die Bildebene geklappt. Bei den beiden inneren Schalen wurde die Darstellung einer kreisförmigen Umlaufbahn beibehalten.
Beide Chloratome haben, wie es sein muss, sieben Elektronen auf ihrer äßersten Schale.