Die Van-der-Waals-Bindung
Es gibt also schwache, anziehenden Kräfte, auch zwischen unpolaren Molekülen. Man erklärt sich das so:
Die Elektronen in einem Atom oder Molekül sind ja in ständiger Bewegung. Deshalb kommt es immer wieder dazu, dass die elektrische Ladung rund um das Molekül ungleichmäßig verteilt ist. Diese ungleichmäßige Ladungsverteilung ruft nun in den Nachbarmolekülen ihrerseits eine Störung der Ladungsverteilung hervor. Immer wieder für kurze Zeit befinden sich also die Moleküle in einem Zustand,
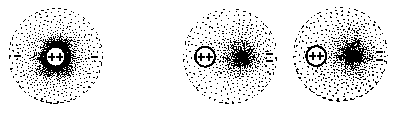
Ein isoliertes Atom hat eine symmetrische Ladungswolke um sich herum. Bei benachbarten Atomen kann eine momentane Asymmetrie auf den Nachbarn polarisierend wirken.
Durch die unterschiedliche Punktedichte soll die Ladungsdichte angedeutet werden.