Die Wasserstoffbrückenbindung
Wie wir im Kapitel über die polare Atombindung gesehen haben, 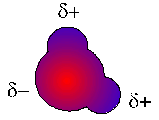 zieht das Sauerstoffatom im Wassermolekül die bindenden
Elektronenpaare etwas zu sich herüber. Wäre das Wassermolekül gerade gebaut (d.h., stünden
die 3 Atome in einer geraden Linie), so würden sich die Ladungsverschiebungen genau ausgleichen und das Molekül
als Ganzes hätte eine gleichmäßig verteilte Ladung.
zieht das Sauerstoffatom im Wassermolekül die bindenden
Elektronenpaare etwas zu sich herüber. Wäre das Wassermolekül gerade gebaut (d.h., stünden
die 3 Atome in einer geraden Linie), so würden sich die Ladungsverschiebungen genau ausgleichen und das Molekül
als Ganzes hätte eine gleichmäßig verteilte Ladung.
Da die beiden Bindungen aber im Winkel zueinander stehen, gibt es diesen Ausgleich nicht. Das Molekül hat also ein Ende mit einer negativen Partialladung und zwei mit einer positven. Dadurch können sich zwei Wassermoleküle gegenseitig elektrisch anziehen, wenn sie sich entsprechend drehen, so dass sie ihre entgegengesetzt geladenen Enden einander zuwenden. Man sagt, es hat sich eine Wasserstoffbrückenbindung ausgebildet.